"Im Gegensatz zu herkömmlichen bioziden Wirkstoffen wird der zeitliche Ablauf der ONOOH-Bildung im Sporosan®-Verfahren genau gesteuert, so dass der Wirkstoff just-in-time und ohne Resttoxizität freigesetzt wird."
Dr. Jörn Winter
CEO und Founder

Besonderheit von Peroxinitritsäure (ONOOH)
Peroxinitritsäure (ONOOH) ist ein ungewöhnlicher biozider Wirkstoff, der bei Raumtemperatur eine Lebensdauer von nur 1 Sekunde aufweist [1]. Diese Eigenschaft in Verbindung mit seiner konkurrenzlosen bioziden Aktivität ermöglicht jedoch völlig neue Verfahren zur Desinfektion auf außergewöhnlich hohem Niveau.
Herkömmliche biozide Wirkstoffe sind in der Regel entweder auf eine hohe Konzentration des Wirkstoffs selbst oder auf lange Einwirkungszeiten angewiesen, um die gewünschte biozide Wirkung zu erzielen. Da der Effekt solcher Wirkstoffe einer Dosis-Wirkungs-Beziehung wie der Haber'schen Regel folgt (Wirkung = Konzentration × Einwirkungszeit), können wir in der Regel zwischen folgendem wählen:
1. hohe Konzentration führt zu schneller antimikrobieller Aktivität, aber schlechter Materialverträglichkeit oder
2. niedrige Konzentration führt zu guter Materialverträglichkeit, aber langsamer antimikrobieller Aktivität
Für die biozide Wirkung von Sporosan® gilt grundsätzlich die Haber'sche Regel, allerdings mit einem kleinen Haken: Da sich das aktive ONOOH nach seiner Entstehung direkt aus seinen Edukten Nitrit und Wasserstoffperoxid zersetzt, ist die Konzentration von ONOOH stark zeitabhängig und kann z.B. über den pH-Wert gesteuert werden.
In nachfolgender Abbildung sind zwei Verfahren dargestellt, die für eine Expositionszeit von 30 Sekunden und 10 Minuten optimiert sind. Beide Verfahren weisen die gleiche biozide Aktivität auf. Das bedeutet, dass beide Verfahren auch die gleiche geringe oxidative Belastung von Materialien und Haut bewirken, wenn auch mit sehr unterschiedlichen Expositionszeiten.
Wie dargestellt, wird ONOOH nur während der Expositionszeit freigesetzt. Nach dieser Zeit ist kein Wirkstoff mehr vorhanden. Im Gegensatz zu anderen persistenten Wirkstoffen ist eine Akkumulation von ONOOH in der Umwelt ausgeschlossen.
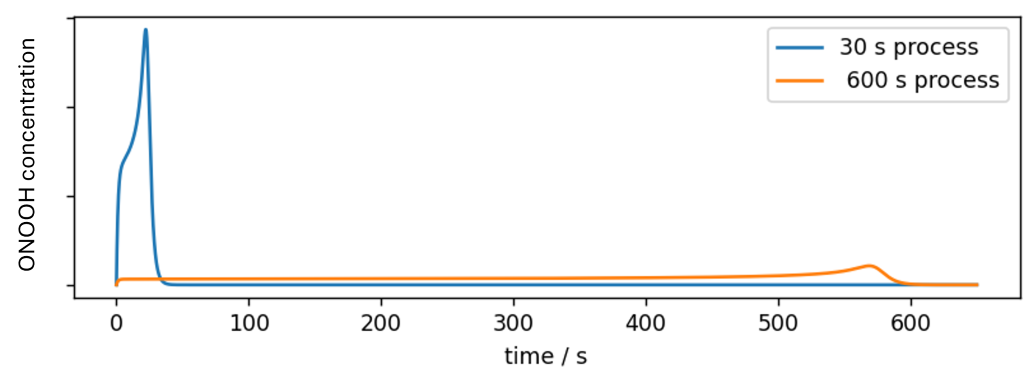
Auch wenn noch längere Prozesszeiten erreicht werden können, ist der Sporosan®-Prozess anderen bioziden Wirkstoffen in der Regel überlegen, wenn kurze Expositionszeiten erforderlich sind. Dies kann auf die Spitze getrieben werden, wie in nachfolgender Abbildung dargestellt, in der ein sporizider Prozess von 5 Sekunden realisiert wird.

Verzögerte Wirkstofffreisetzung
Solche extrem schnellen Verfahren haben den Nachteil, dass sie anfällig für Handhabungsfehler sind, z. B. kann das Desinfektionsmittel nach der vorgesehenen Einwirkzeit nicht mehr verwendet werden, da der biozide Wirkstoff vollständig verschwunden ist. Daher sind solche Formulierungen nur für automatisierte Desinfektionsverfahren, z. B. in Reinigungs- und Desinfektionsgeräten, von Interesse.
Um jedoch Systeme zu erhalten, die für die manuelle Desinfektion von Oberflächen geeignet sind, kann dem Gemisch ein Verzögerer zugesetzt werden, der verdunstet, sobald das Desinfektionsmittel auf eine Oberfläche aufgetragen wird. Während das Verzögerungsmittel die Reaktion von Wasserstoffperoxid und Nitrit auf der Zeitskala der Reaktion vollständig hemmt, setzt die Reaktion ein, sobald eine erhebliche Menge des Verzögerers verdunstet ist. Die typische zeitliche Entwicklung von ONOOH bei der Anwendung eines solchen Desinfektionssystems auf einer Oberfläche ist in folgender Abbildung dargestellt.
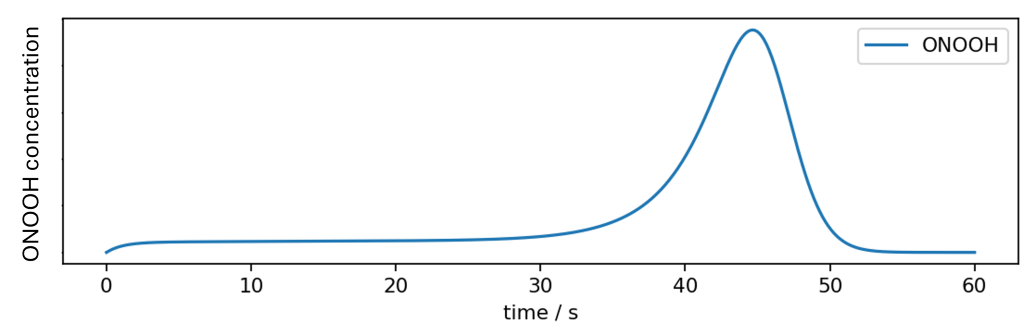
Solche Verfahren kommen dem idealen zeitlichen Profil der bioziden Aktivität bei der Flächendesinfektion sehr nahe:
- Keine Aktivität, während das Desinfektionsmittel verteilt wird,
- hohe Aktivität, wenn das Desinfektionsmittel verdunstet,
- vollständige Breitbanddesinfektion und keine toxischen Rückstände, wenn das Desinfektionsmittel verdunstet ist.
Chemie des Sporosan®-Prozesses
Das Sporosan®-Verfahren basiert auf der Erzeugung von ONOOH aus Nitrit und Wasserstoffperoxid unter sauren Bedingungen. Diese Kombination ist ein neuartiger antimikrobieller Wirkstoff, der bisher noch nicht in Desinfektionsprodukten verwendet wurde. Das im Sporosan®-Verfahren erzeugte ONOOH kann nur unter sauren Bedingungen gemäß den folgenden Reaktionen gebildet werden [2]:
\[ \begin{aligned} \text{H}_2\text{O}_2 + \text{H}_3\text{O}^+ &\rightleftharpoons \text{H}_3\text{O}_2^+ + \text{H}_2\text{O} \quad &\text{(R1)} \\ \text{N}\text{O}_2^- + \text{H}_3\text{O}^+ &\rightleftharpoons \text{H}\text{NO}_2 + \text{H}_2\text{O} \quad &\text{(R2)} \\ \text{H}_3\text{O}_2^+ + \text{HNO}_2 &\rightarrow \text{ONOOH} + \text{H}_3\text{O}^+ \quad &\text{(R3)} \end{aligned} \]
Reaktionen (R1) bis (R3) können in der Netto-Reaktionsgleichung
\[ \begin{aligned} \text{HNO}^{\text{tot}}_2+\text{H}_2\text{O}_2 &\rightarrow \text{ONOOH}+ \text{H}_2\text{O} \quad &\text{(R4)}\end{aligned} \]
zusammengefasst werden, wobei \(\text{HNO}^{\text{tot}}_2\) die Summe aus \(\text{NO}_2^-\) und der zugehörigen konjugierten Säure \(\text{HNO}_2\) ist.
Aufgrund der starken pH-Abhängigkeit der Reaktion R4 benötigt das Sporosan®-Verfahren immer einen sauren pH-Wert (typischerweise zwischen 2 und 3,5), um Prozesszeiten im Bereich von wenigen Sekunden bis zu mehreren Minuten zu erreichen.
Die Lebensdauer der Peroxinitritsäure beträgt 1 Sekunde. Nach dieser Zeit isomersiert ONOOH teilweise zu Salpetersäure (HNO3) oder zerfällt zu Hydroxylradikalen und Stickstoffdioxid [3]:
\[ \begin{aligned} \text{ONOOH} &\rightarrow \text{NO}_2 + \text{OH}\quad &\text{(R5)} \\ \text{ONOOH}&\rightarrow \text{NO}_3^- + \text{H}^+\quad &\text{(R6)} \end{aligned} \]
Da NO₂ gut in Wasser löslich ist und der pKa-Wert von HNO₃ mit -1,3 weit unter den in Sporosan®-Anwendungslösungen vorkommenden pH-Werten liegt, kann nur ein geringer Teil aus der Lösung ausgasen, während der größte Teil des NO₂ direkt zu NO₃⁻ gemäß
\[ \begin{aligned} \text{NO}_2+\text{OH} &\rightarrow \text{NO}_3^- + \text{H}^+\quad &\text{(R7)} \end{aligned} \]
reagiert. Daher kann der gesamte Prozess als Umwandlung von NO₂⁻ in NO₃⁻ mit ONOOH als Zwischenprodukt beschrieben werden.
Unterscheidung zwischen endogenem ONOO⁻ und ONOOH erzeugt aus NO₂⁻ und H₂O₂
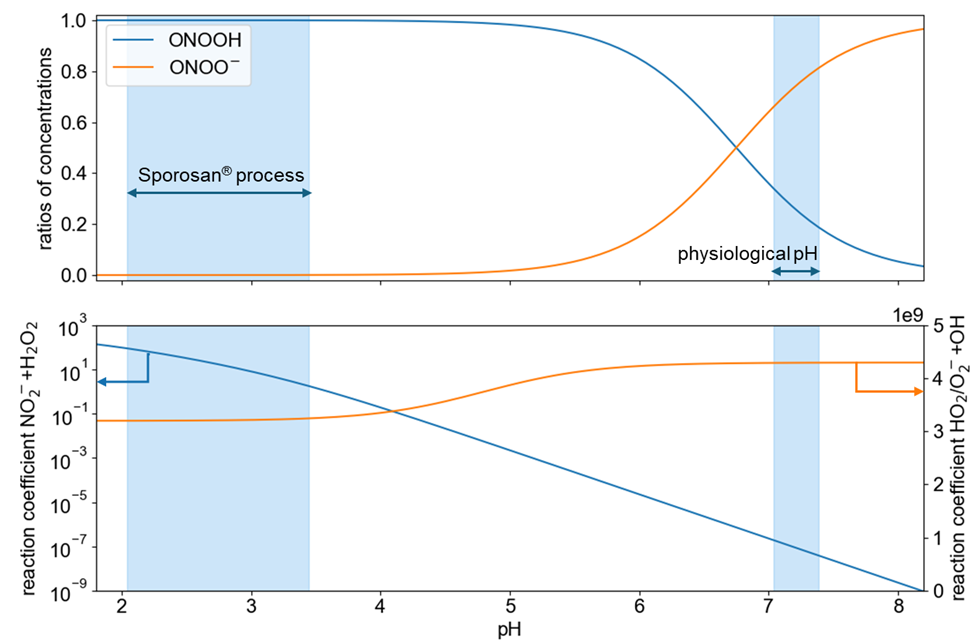
Die aktuelle Literatur befasst sich hauptsächlich mit endogenem Peroxynitrit (ONOO⁻). Dieses konjugierte ONOOH-Anion (pKs 6,8 [4]) ist weithin als antimikrobielle Spezies bekannt, die von Makrophagen als Teil der angeborenen Immunantwort ausgeschüttet wird [5]. Bei einem physiologischen pH-Wert von z. B. 7,0 bis 7,4 ist ONOO⁻ die dominierende Spezies, während im pH-Bereich des Sporosan®-Verfahrens, bei dem ein pH-Wert zwischen 2,0 und 3,5 verwendet wird, ONOOH eindeutig die dominierende Spezies ist (siehe nachfolgende Grafik, oben). Während ONOO⁻ bei alkalischem pH theoretisch stabil ist, reagiert es schnell mit CO₂, was seine weitere biologische Wirkung vermittelt und zu einer effektiven Lebensdauer von 1-2 ms [6] bei physiologischen CO₂-Konzentrationen führt. Im Körper wird ONOO⁻ aus Superoxid (O₂⁻) oder Hydroperoxyl (HO₂) und Stickstoffmonoxid (NO) gebildet. Dieser Prozess ist weitgehend unabhängig vom pH-Wert, wie in der nachfolgenden Abbildung (unten) dargestellt.
Im Gegensatz dazu ist die im Sporosan®-Verfahren eingesetzte Reaktion R4 stark pH-abhängig, was die Bildung von ONOOH bei physiologischem pH praktisch unmöglich macht:
Ein typischer Sporosan® -Prozess, der normalerweise in der Größenordnung von 15 Sekunden abläuft, würde bei einem pH-Wert von 7 ungefähr 3 Jahre dauern. Daher ist eine direkte systemische Wirkung von durch Sporosan® erzeugtem ONOOH weder zu erwarten noch experimentell zu beobachten.
Literatur:
[1] C. Molina, R. Kissner, and W. H. Koppenol, "Decomposition kinetics of peroxynitrite: influence of pH and buffer," Dalton Transactions, vol. 42, no. 27, p. 9898, 2013. doi: 10.1039/c3dt50945a. [Online]. Available: http://xlink.rsc.org/?DOI=c3dt50945a
[2] D. Vione, V. Maurino, C. Minero, D. Borghesi, M. Lucchiari, and E. Pelizzetti, "New processes in the environmental chemistry of nitrite. 2. The role of hydrogen peroxide," Environmental Science and Technology, vol. 37, no. 20, pp. 4635–4641, 2003, doi: 10.1021/es0300259.
[3] S. Goldstein, J. Lind, and G. Merényi, "Chemistry of peroxynitrites as compared to peroxynitrates," Chemical Reviews, vol. 105, no. 6, pp. 2457–2470, 2005, doi: 10.1021/cr0307087.
[4] R. Radi, "Oxygen radicals, nitric oxide, and peroxynitrite: Redox pathways in molecular medicine," Proceedings of the National Academy of Sciences of the United States of America, vol. 115, no. 23, pp. 5839–5848, 2018, doi: 10.1073/pnas.1804932115.
[5] L. Zhu, C. Gunn, and J. S. Beckman, "Bactericidal activity of peroxynitrite," Archives of Biochemistry and Biophysics, vol. 298, no. 2, pp. 452–457, 1992, doi: 10.1016/0003-9861(92)90434-X.
[6] S. Goldstein, G. Czapski, J. Lind, and G. Merényi, "Carbonate radical ion is the only observable intermediate in the reaction of peroxynitrite with CO2," Chemical Research in Toxicology, vol. 14, no. 9, pp. 1273–1276, 2001, doi: 10.1021/tx0100845.